
Stellen wir uns den Menschen als ein Konstrukt aus Legosteinen vor. Aus vielen Millionen Legosteinen. Aber der menschliche Körper ist kein schlichter massiver Block. Nein, er besteht aus über fünfzig einzelnen Lego-Modulen. Kopf, Arme, Beine, Torso und auch jedes Organ sind ein Modul. Dabei braucht jedes Modul seine eigenen Steinchen: 2x4 Rechtecke, 2x2 Quadrate, gelbe Fensterrahmen, rote Dachschindeln und viele weitere. Als Legomodell bräuchte der Mensch wahrscheinlich eine 2000-seitige Bauanleitung.
Die Legosteine des menschlichen Organismus, die Bausteine der Natur, sind die Zellen. Endothelzellen, Nierenzellen, rote Blutkörperchen und so weiter. Nach bisherigen Erkenntnissen gibt es 500
unterschiedliche Zellarten im menschlichen Körper. In der Biologie ist es mittlerweile möglich, diese Zellen außerhalb des Körpers in Petrischalen oder kleinen Flaschen zu züchten, das nennt man
dann eine Zellkultur. Solche Zellkulturen werden genutzt, um die chemischen Prozesse in den gezüchteten Zellarten zu beobachten oder auch um Wirkstoffe an ihnen zu testen. Und wenn ein neues
Medikament entwickelt wird, so müsste der Wirkstoff logischerweise an Zellkulturen aller 500 Zellarten getestet werden, um – bevor er einem Menschen verabreicht wird – sicherzugehen, dass er
keine schweren Nebenwirkungen verursacht. Leider genügt es nicht zu beobachten, wie ein Wirkstoff auf eine Zellkultur von Endothelzellen wirkt, um zu wissen, wie etwa feinste Blutadern, die
Kapillaren, bei einer Medikamenteneinnahme reagieren. Denn Zellen verhalten sich in einer Monokultur nicht auf dieselbe Weise wie im Verbund mit anderen Zellen. Erkenntnisse aus
Zellkulturversuchen reichen nicht, um die Wirkung eines Wirkstoffs vorherzusagen. Gleichzeitig kann ein neuer Wirkstoff nicht einfach einem Menschen verabreicht werden, denn die Risiken sind
hoch, dass er durch einen körperfremden Wirkstoff vergiftet wird.
Zwischen Zelle und Organismus steht das Organoid
Doch die Wissenschaft hat mittlerweile einen Zwischenweg gefunden. Zwischen Zellkulturen, die nur zweidimensionale Zellteppiche bilden, und einem vollständigen Organismus. Und zwar
dreidimensionale Zellhaufen, die Organoide. In diesen liegen die Zellen in Schichten übereinander und verhalten sich sehr viel mehr wie ein menschliches Organ. Organoide sind gerade einmal mit
dem bloßen Auge sichtbar, oft nur unter dem Mikroskop.
https://www.laborjournal.de/rubric/special/special/2020_05_02.php
Die Biologie ist aber noch komplizierter. Besteht ein Organoid nicht nur aus einer Zellart, sondern aus zwei Arten, aus sogenannten Co-Kulturen, beginnen viele Zellarten sogar körpereigene
Wirkstoffe wie Hormone und Wachstumsfaktoren zu produzieren. Zum Vergleich: Bei eindimensionalen Monokulturen gelang das nur, wenn biologische Wirkstoffe zugeführt wurden, um die Produktion
auszulösen. Organoide aus mehreren Zellarten sind also schon fast kleine Organe. Ihre Reaktionen auf äußere Einflüsse wie Giftstoffe, Hormone oder eben neue pharmazeutische Wirkstoffe sind fast
dieselben wie bei menschlichem Gewebe. Diese Eigenschaft machen sich Entwicklungslabore längst zunutze, indem sie die Organoide auf sogenannten Organ-on-a-Chip-Systemen einsetzen.
Eine Zelle, zwei Zellen. Ein Organoid, zwei Organoide. Ein Mensch …
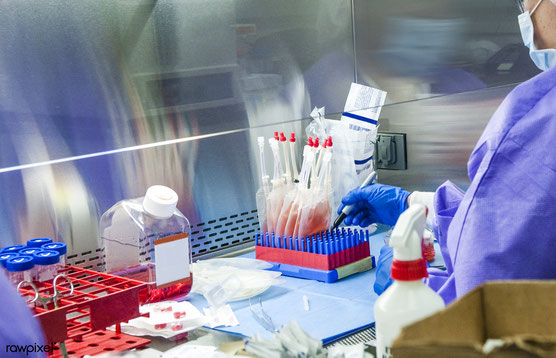
Stellen Sie sich ein biologisches Labor vor. An den Wänden stehen große weiße Brutschränke mit schweren Türen. Eine rote Digitalanzeige zeigt die Innentemperatur der Schränke an, 37.5 °C.
Auf einem Tisch liegen einige Hubkolbenpipetten, die aussehen wie große Kugelschreiber, mit diesem länglichen Knopf obenauf.
In einer quadratischen Plastikflasche mit weißem Deckel schwappt eine rosarote Flüssigkeit, und wenn Sie die Flasche gegen die Deckenlampe halten, sehen Sie darin kleine Krümelchen schwimmen.
Organoide.
Ein Laborant in weißem Kittel und mit Schutzbrille setzt eine Pipettenspitze auf das untere Ende einer Pipette. Er öffnet den Deckel der Flasche. Mit dem Daumen drückt er auf den Knopf oben auf
der Pipette, sticht in die rosarote Flüssigkeit, zieht den Daumen zurück und eine kleine Menge rosa Flüssigkeit wird eingesaugt. Die Flüssigkeit beinhaltet ein winziges Organoid.
Der Laborant holt eine Plastikschale hervor, keine einfache, sondern eine, in der vierundzwanzig Vertiefungen liegen. Ähnlich einer Toffifee-Schale.
Der Laborant träufelt ein Organoid in eine Vertiefung. Das Organoid besteht aus Nierenzellen und Zellen, aus denen Blutadern gemacht sind, Endothelzellen. In eine andere Vertiefung träufelt er
ein anderes Organoid, eines, das aus Herzmuskelzellen besteht und ebenfalls aus Endothelzellen. Das dritte Organoid, bestehend aus zwei unterschiedlichen Zellarten aus der Leber, und so
weiter.
Auf diese Weise würde praktisch jedes Organ des Menschen abgebildet werden, in einer Schale, die kaum so groß ist wie eine Buchseite. Danach würde eine Mischung aus Nährlösung und Medikament in
alle Vertiefungen geträufelt, und schon könnte der Laborant, mit speziellen Analysegeräten, genau beobachten, wie der neue Wirkstoff auf jedes Organ eines Menschen reagiert. Ganz ohne Mensch,
ganz ohne Tierversuche.
Dieses Verfahren heißt Organ-on-a-Chip.
Ganz einfach, oder doch nicht?
Die amerikanische Regierung hat nun die Pflicht zu Tierversuchen bei klinischen Studien einkassiert. Für toxikologische Untersuchungen müssen keine Tiere mehr sterben. Die Toxikologie soll
stattdessen etwa durch Organoide oder Computermodelle bestimmt werden.
Ein deutscher Beitrag dazu könnte aus Reutlingen kommen. Am naturwissenschaftliches und Medizinisches Institut NMI
wird seit vielen Jahren an Leberorganoiden geforscht, die auf Organ-on-a-Chip installiert werden. Mit diesem HepaChip kann also alleine im Labor mit einem Analysegerät die Toxikologie eines Wirkstoffs überprüft werden.
Maschinell, schnell, zuverlässig.
https://pubmed.ncbi.nlm.nih.gov/32662810/
Am NMI arbeitete auch Christoph Mätzer, der Protagonist in meinem neuen Roman, »Ninas Niere«.
Amazon KDP Link: NINAS NIEREN
Mit freundlichen Grüßen, Niko Herwegh.